|
 |
|
عند دراسة
موضوع الإلكترونيات يكون من المهم جداً معرفة التركيب البنائي
للمادة حيث أن ذلك يعتبر حجر الأساس لفهم طبيعة المواد شبه
الموصلة التي هي أساس صناعة الترانزستور ، ولما كانت المادة
تتركب أساساً من ذرات يتوقف على طبيعة تركيبها وترتيبها
خواص
المادة المكونة لها كان من الضروري التعرف على التركيب البنائي
للذرة.
|
تركيب
الذرة |
The Structure of
the Atom
|
من المهم
معرفة طريقة سريان التيار في موصل ، ففي الموصل
النحاسي
يكون هناك إلكترون من كل ذرة نحاس حراً في الحركة من ذرة إلى
أخرى ونظراً لوجود عدد هائل من ذرات النحاس في الموصل فإن
الإلكترونات ( الحرة ) في الموصل تُشكل سحابة من الإلكترونات.
|
|
عند تسليط قوة دافعة كهربائية ( emf
) بين نهايتي الموصل
تتحرك
الإلكترونات من هذه السحابة باتجاه الخروج من إحدى النهايتين
ويدخل عدد مساوي من الإلكترونات من النهاية الأخرى للمحافظة
على كمية الإلكترونات الكلية في السحابة ثابتة يُسمى هذا
السريان الإجمالي للإلكترونات التيار الإلكتروني (
Electronic
Current
) ولمزيد من الفهم يجب أن نتعرض لتركيب الذرة بشكل أوضح. |
|
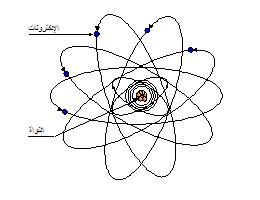
تتركب الذرة من نواة (
Nucleus
) في المركز ثم
توجد مدارات بيضاوية
حول المركز تدور فيها الإلكترونات، وتعتبر الذرة في حالتها
الطبيعية متعادلة كهربياً وحيث أن كل إلكترون يمثل كمية محددة
من الشحنة السالبة لذلك توجد كمية أخرى موجبة لمعادلة الشحنة
السالبة، هذه الشحنة الموجبة توجد في جسيمات في مركز الذرة
تُسمى بروتونات (Protons)
وعلى ذلك فإن عدد الإلكترونات في ذرة ما يكون مساوياً لعدد
البروتونات لكي تصبح الشحنة الكهربائية الكلية تساوي صفراً.
كذلك تحتوي النواة على مكونات ذات شحنة متعادلة تسمى نيترونات
(Neutrons) |
 |
|
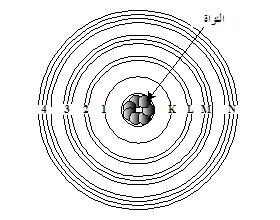
عندما تدور
الإلكترونات حول النواة
فإنها
تدور في مدارات
مقيدة
بمسافات محددة عن مركز الذرة هذه المدارات تُسمى أغلفة (Shells) في صورة طبقات فوق بعضها يُرمز لها بالحروف (
K, L,
M, N, O, P, Q
) أو بالأعداد
(1،
2، 3، 4، 5، 6،
7)
والغلاف الأول القريب من النواة هو الغلاف (
K
) أو رقم (1)ثم الذي يليه (
L
)
أو (2)
وأبعدها هو ( Q
) أو رقم (7) وكل مدار من هذه المدارات هو
في الحقيقة مكون من عدد من المدارات الثانوية يرمز لها بالحروف
(
s, p, d, f
) ومصدر هذه الحروف هي |
 |
|
الاصطلاحات التي أُتبعت في
دراسة التحليل الطيفي للمواد (
sharp,
principal, diffuse,
fundamental
)
فإذا فحصنا أحدها مثل الغلاف (
L
) سوف نجد أنه يتكون من غلافين
ثانويين
متقاربين جداً والغلاف (
M
) له ثلاثة
أغلفة ثانوية والغلاف (
N
) له أربعة أغلفة ثانوية وبما أن الأغلفة متقاربة جداً من
بعضها في غلاف معين فإن الطاقة اللازمة لحركة إلكترون بين
الأغلفة الثانوية صغيرة جداً بالمقارنة مع الطاقة المطلوبة
لإزاحة إلكترون من أحد الأغلفة الرئيسية إلى آخر.وأقصى عدد في
كل غلاف محدد بالقاعدة: |
|
 |
|
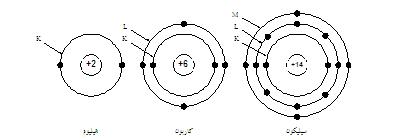
S=2n2
حيث :
(
S
) عدد الإلكترونات
( n
) رقم المدار .
مثال: عدد
الإلكترونات في الغلاف (
L
) أو رقم (
2
) هو
S=2(2)2 = 8 electrons
أي أن المدار
الثاني لا يستطيع أن يقبل أكثر من
ثمانية
إلكترونات،
فإذا كانت ذرة مادة السليكون تحتوي على (14 إلكترون ) فإن ذلك يعني أن المدار الأول سوف يحتوي
على ( 2 إلكترون) والمدار الثاني يحتوي على (8 إلكترون)والباقي وهو
(4 إلكترون) يكون في المدار الثالث والذي يستطيع أن يستوعب (
18 إلكترون ). |
|
معنى ذلك إنه
قبل أن تتواجد الإلكترونات في الغلاف
الثاني
يجب أن يكون الغلاف الأول قد امتلأ بالحد الأقصى له طبقاً
للمعادلة السابقة ولا توجد إلكترونات في المدار الثالث قبل أن
يمتلئ المدار الثاني بالحد الأقصى له وهكذا . ومع أنه يوجد
عدد أكبر من الإلكترونات في
الأغلفة
الخارجية الأكثر بعداً عن الأغلفة التي تسبقها إلا أن الغلاف
الخارجي للذرة لا يمكن أن يحتوي على أكثر من
ثمانية
إلكترونات، كما لا يمكن أن تكون الأغلفة الخامس، السادس،
السابع كاملة العدد من الإلكترونات والسبب هو أن الإلكترونات
تبدأ في شغل الأماكن في أغلفة جديدة قبل أن يتم شغل كل الأماكن
في الأغلفة السابقة.
يُحدد الغلاف
الخارجي
والمسمى
( غلاف التكافؤ
/
Valence
shell
) النشاط الكيميائي للعنصر فإذا كان الغلاف الخارج ممتلئاً
بالكامل بالإلكترونات فإن المادة تكون خاملة ولا تتفاعل
كيمائياً مثال: النيون (10 إلكترون) الغلاف الأول يحتوي على (2
إلكترون ) والغلاف الثاني يحتوي على ( 8 إلكترون ) وهو الحد الأقصى لهذا الغلاف.
إذا كان
الغلاف الخارجي غير
ممتلئ
فإنه يمكن أن يتحد
بروابط كيميائية مع ذرات أخرى ليعطي نفس تأثير الأغلفة
الخارجية الممتلئة. والإلكترون
يجب أن يكون في أحد
الأغلفة بمعنى أنه
لا يمكن أن يستقر بين الأغلفة. ولكي نسمح لإلكترون بأن يتحرك
من غلاف إلى آخر فإنه يتطلب كميات محددة من الطاقة ( quanta
) هذا الكم من الطاقة هو أصغر وحدة من الطاقة يمكن أخذها في
الاعتبار. فإذا كانت الطاقة المطلوبة لإزاحة إلكترون من أحد
الأغلفة إلى آخر بمقدار (4) وحدات فإن طاقة
قدرها (3) وحدات لا تستطيع أن تصنع إزاحة. |
|
حزم الطاقة
Energy Bands |
|
لا تمتلك المواد شبه
الموصلة إلكترونات تملأ جميع مستويات الطاقة المسموحة من
الأغلفة الثانوية الخارجية للذرة وطبقاً لمبادئ بولي للاستبعاد
( pauli,s exclusion principle ) للفيزياء فإنه لا يوجد
إلكترونين خلال منظومة واحدة لهما نفس مقدار الطاقة تماماً
لذلك عند وجود عدد معين من مستويات الطاقة فإن لكل مستوى منها
قيمة مختلفة عن الآخر. |
|
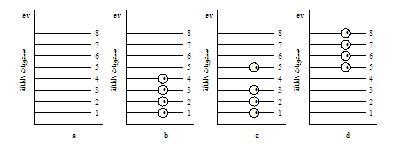
إذا أخذنا ذرة لها أربعة
إلكترونات في الغلافين الخارجيين ولها ثمان حالات لمستوى طاقة
ممكنة مسموح بها. فإن الإلكترونات الأربعة تكون موجودة في
مستويات الطاقة الأربعة السفلي (1, 2, 3, 4) فعند إمداد هذه
المنظومة بالطاقة فإن الإلكترون الموجود في المستوى رقم (4)
يتحرك إلى المستوى الأعلى رقم (5) |
 |
|
وكلما زادت الطاقة الداخلة
إلى الذرة فإن الإلكترونات تتحرك حتى تصل إلى الوضع النهائي
للمستويات (5, 6, 7, 8) وتبقى المستويات (1, 2, 3, 4) خالية. |
|
تتكون المادة الصلبة من عدد
هائل من الجزيئات التي ترتبط مع بعضها وعلى ذلك فإن جميع
المستويات لجميع الجزيئات يجب أن تكون مختلفة وذلك استناداً
إلى مبادئ بولي للاستبعاد . ونظراً لأن الخطوط المفردة كثيرة
جداً لذا يندمج عدد من هذه الخطوط على هيئة حزم ( Bands )
وينقسم العدد الكلي لمستويات الطاقة في الأغلفة الثانوية
الخارجية إلى نوعين: |
|
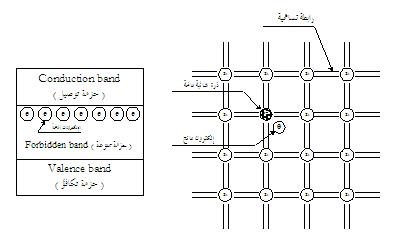
|
|
 |
-
في الموصل النحاسي
تندمج حزمة التكافؤ مع حزمة التوصيل شكل (
a
) فإذا سلطت قوة دافعة كهربائية (emf)
صغيرة على الموصل فهي كافية لإحداث سريان التيار.
-
في العازل جميع
الإلكترونات في الأغلفة الخارجية الثانوية تكون في حزمة
التكافؤ بالإضافة إلى وجود فجوة كبيرة بين مستويات الطاقة
السفلي المسوح بها لحزمة التكافؤ ومستويات الطاقة العليا
المسموح بها لحزمة التوصيل شكل (
b
) وتُسمى هذه الفجوة بالحزمة الممنوعة (
Forbidden
band
) والتي لا تحتوي على حالات لمستويات طاقة مسموح بها وعلى
ذلك يمكن إهمال حركة الإلكترونات في الظروف العادية. فإذا
سلطت جهداً على عازل فإن الإلكترونات تحتاج إلى طاقة معينة
لعبور الفجوة الممنوعة إلى حزمة التوصيل وعند حدوث ذلك
يسري التيار في العازل ونقول أن العازل قد انهار تحت تأثير
الجهود العالية.
-
المواد الأساسية المستخدمة
في أشباه الموصلات هي عناصر لها ثمان حالات طاقة مسموح بها
في الغلاف الثانوي الخارجي ولها أربعة إلكترونات في
الأغلفة الثانوية الخارجية مثال ( السليكون ، الجرمانيوم )
. عندما تتكون مادة صلبة من ذرات السليكون أو الجرمانيوم
نحصل على حزمتين للطاقة منفصلتين بفجوة ضيقة شكل (
c
) تكون أربع من حالات مستويات الطاقة المسموح بها لكل ذرة
في حزمة التوصيل وأربع من حالات الطاقة المسموح بها في
حزمة التكافؤ وللحصول على سريان للتيار الكهربائي في
المادة فإنه يجب تجهيز طاقة خارجية كافية لجعل الإلكترونات
تعبر الحزمة الممنوعة إلى حزمة التوصيل.
|
|
بلورات الجرمانيوم والسليكون
|
Germanium and
Silicon Crystals
|
تتوزع الذرات
في البلورة
على شكل نماذج
هندسية متماثلة، في بلورات السليكون والجرمانيوم كل ذرة لها
رابطة مع كل من أربع ذرات أخرى مكونة تركيباً رباعياً كل
ذرة
لها أربع إلكترونات في الغلاف الخارجي ولما كان الغلاف الخارجي
يمكن أن يستوعب حتى ثمانية إلكترونات لذا عند مشاركة إلكترونات
الغلاف الخارجي للذرات المتجاورة فإن الأغلفة الخارجية ستكتمل
بسبب إلكتروناتها الأربعة مضافاً إليها أربعة إلكترونات من
الذرات المجاورة ( إلكترون من كل ذرة ) مما يرفع العدد إلى
ثمانية إلكترونات وهو الحد الأقصى المسموح به للغلاف الخارجي.
وتُسمى مشاركة إلكترون بين ذرتين لنفس المادة رابطة تساهمية (
Covalent band
) وفي المواد شبه الموصلة تكون الروابط
التساهمية على شكل أزواج وفي الشكل يمثل كل خط إلكتروناً
مشتركاً مكوناً رابطة تساهمية. |
|
|
|
المادة شبه الموصلة النقية |
Intrinsic
Semiconductor Material
|
كما
سبق
توضيحه فإن المادة البلورية
المصنوعة
من السليكون النقي أو الجرمانيوم النقي تعتبر مادة شبه موصلة
نقية. فعندما تكون المادة في درجة حرارة الصفر المطلق تكون
جميع الإلكترونات في حزمة الطاقة رابطة تكافؤية ولا وجود لأي
منها في حزمة التوصيل لذلك فإن المادة تكون عازلاً مثالياً.
-
فجوة الطاقة (Energy Gap_EG): تقل
كلما
زادت درجة الحرارة المحيطة بالمادة شبه الموصلة المصنوعة من
السليكون أو الجرمانيوم فإذا سُخنت هذه المادة فإن الإلكترونات
سوف تقفز تاركة حزمة التكافؤ إلى حزمة التوصيل.
-
عند
درجة حرارة الغرفة يحدث عبور
للإلكترونات
من حزمة التكافؤ إلى حزمة التوصيل انتقال الإلكترون من حزمة
التكافؤ يترك وراءه فجوة إلكترونية (
Hole
)
-
في
البلورة النقية عدد الإلكترونات في
حزمة
التوصيل مساوياً لعدد الفجوات الإلكترونية في حزمة التكافؤ أي
إلكترون لك فجوة (electron
–
hole
pairs)
-
في
حزمة التوصيل تكون الإلكترونات حرة
في
التنقل، وبصورة مشابهة إذا تحرك إلكترون في حزمة التكافؤ لملئ
فجوة إلكترونية فإنه سوف يترك فجوة إلكترونية في المكان الذي
جاء منه. لذلك يمكن الحصول على تيار في حزمة التوصيل وتيار
مستقل في حزمة التكافؤ والذي
ينتج
عن قفز الفجوات الإلكترونية من ذرة إلى أخرى.
-
الإلكترون الموجود في حزمة
التوصيل
له مستوى طاقة أعلى من الفجوة الإلكترونية الموجودة في حزمة
التكافؤ.
-
الإلكترون الواقع في حزمة التوصيل يتطلب
لتحريكه طاقة إضافية من مصدر خارجي أقل من الطاقة اللازمة
لتحريك الإلكترون الواقع في حزمة التكافؤ. وعلى ذلك فإن الجزء
الأكبر من التيار يكون ناشئاً عن إلكترونات حزمة التوصيل كما
سيكون هناك في الوقت نفسه تيار فجوات
إلكترونية
ذو قيمة صغيرة. أي أن الإلكترونات هي حاملة لتيار الأغلبية
والفجوات الإلكترونية حاملة لتيار الأقلية وتساهم
كلتا
الحاملات في صنع التيار الكلي.
|
|
المادة نوع
(
N
) |
N – Type Material |
|
تُسمى
العناصر التي لها خمسة إلكترونات
في
الغلاف
الخارجي (
المجموعة
الخامسة في الجدول الدوري ) عناصر خماسية التكافؤ وتُستخدم
العناصر خماسية التكافؤ في تصنيع أشباه الموصلات مثل : (
الفسفور ، الزرنيخ ) ويتم تشكيل المادة من نوع (
N
) عندما يدخل أحد هذه العناصر بدقة وبمعدل متحكم فيه وفي حدود
( جزء واحد لكل 10 مليون ) إلى بلورة الجرمانيوم النقية أو
بلورة السليكون النقية. هذه العملية تُسمى التطعيم (
Doping ) غالباً ما تُسمى هذه الذرات الداخلة
بالذرات الشائبة (
impurity
atoms
) لتمييزها عن ذرات الجرمانيوم أو السليكون الموجودة في
التركيب البلوري.
تزيح كل ذرة
شائبة ذرة جرمانيوم
أو سليكون في
التركيب البلوري وعلى ذلك فإن التركيب البلوري الجديد يكون غير
نقي. ولما كانت الذرة ذات التكافؤ الخماسي تكون مرتبطة بأربع
روابط تساهمية مع أربع ذرات مجاورة فإن الإلكترون الخامس يكون
غير مرتبط مع الذرة الأم ولكن بإمكانه ( الانتقال ) خلال
البلورة . |
|
 |
|
بما أن الذرات
خماسية التكافؤ
تُضيف
إلكتروناً طليقاً
إلى البلورة فإنها
تُسمى
ذرات مانحة ( donor
atoms
) وعلى ذلك فإن المادة من نوع (
N
) ذات إلكترونات أكثر من البلورة النقية ولكن يجب أن نتذكر أن
أن قطعة من هذه المادة تكون متعادلة عندما يتعلق الأمر بالشحنة
الكلية حيث أن عدد الشحنات الموجبة يكون مساوياً مع عدد
الشحنات السالبة في كتلة المادة وفي حالة وجود إلكترون طليق
إضافي فإن خاصية الذرة المانحة هي أن تحتوي في تركيبها شحنة
موجبة في نواتها أكثر مما تمتلكه ذرة المادة الأصلية النقية
ويكون الإلكترون طليقاً في الذرة المانحة لأنها جزء من تركيب
بلوري منتظم وعند تلف هذا التركيب البلوري فإن الإلكترون لن
يصبح عند ذلك طليقاً. |
|
تكون الطاقة
اللازمة لكسر
الرابطة التساهمية في
المواد
شبه
الموصلة
النقية بحدود ( 0.7_1.1 v
) وعند تشكيل مادة نوع (
N
) فإن مستوى الطاقة للإلكترونات الإضافية يكون في حدود (
0.01 v
) فقط تحت حزمة التوصيل. وحيث أن الطاقة الواصلة إلى هذه
الإلكترونات في درجة حرارة الغرفة بواسطة الحرارة يكون في حدود
(
0.02 v
) فإن الإلكترونات تنتقل إلى حزمة التوصيل. لذلك وبالإضافة إلى
الإلكترونات المانحة توجد أيضاً إلكترونات من العلاقة (إلكترون/فجوة إلكترونية) في حزمة التوصيل وفجوات إلكترونية
في حزمة التكافؤ تساهم أيضاً في سريان التيار وتكون النتيجة
أنه في المادة نوع (
N
) تكون:
|
 |
|
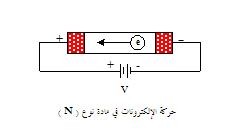
إذا
أخذنا كتلة من نوع (
N
) ذات نهايات
توصيل معدنية عند
طرفيها
متصلة
بمصدر
قوة دافعة كهربائية (v) فسوف يتحرك الإلكترون في حزمة التوصيل خلال المادة نوع (N)
إلى النهاية المعدنية الموجبة ثم الموصل الخارجي، وفي نفس
الوقت يدخل إلكترون آخر من النهاية المعدنية السالبة إلى
المادة من نوع (N) لذا فلا يوجد تغيير في العدد الكلي للإلكترونات في كتلة
المادة من نوع (N) التيار الناتج هو (I) بالأمبير
وذلك من خلال العلاقة:
حيث (
R
) هي المقاومة الكلية لكتلة المادة من نوع (
N
)
إذا
كانت هناك فجوة إلكترونية في المادة من نوع (N) فإن حركتها
تكون باتجاه النهاية السالبة للمصدر الكهربائي وذلك لأن
الفجوات الإلكترونية تُمثل الشحنة الموجبة . |
|
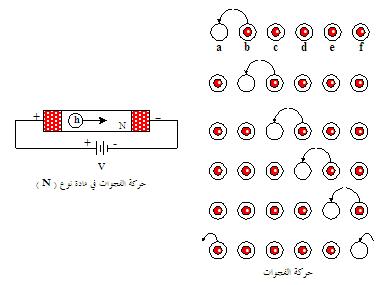 |
الشكل يوضح
طبيعة توليد تيار
بواسطة
الفجوات الإلكترونية،
نفرض
أن الفجوة الإلكترونية عبارة عن دائرة فارغة وكل فجوة بها
إلكترون ( دائرة مظللة ) سنلاحظ أن الإلكترونات تقفز إلى
الدائرة الفارغة فعندما يقفز إلكترون من الدائرة (b) إلى الدائرة (a) فإن الدائرة (b) تُصبح فارغةً وعليه يقوم الإلكترون في الدائرة (c) بالقفز إلى
الدائرة (b) مخلفاً وراءه دائرة فارغة ليقفز فيه إلكترون من الدائرة (d)
وهكذا . سنلاحظ أن حركة الإلكترونات في انتقالها عبر الدوائر
الفارغة تتحرك جهة اليسار بينما تتحرك الدوائر الفارغة
(الفجوات الإلكترونية) جهة اليمين تبعاً لذلك |
|
يأتي التيار
في مادة نوع (N) من الإلكترونات الحرة الحركة
في
حزمة التوصيل ، الآن لدينا تياراً إضافياً ناتج عن الفجوات
الإلكترونية المتحركة في الاتجاه العكسي نتيجة لذلك فإن التيار
الكلي في المادة من نوع (N) هو مجموع تيار الإلكترونات ( تيار الأغلبية ) في حزمة
التوصيل مضافاً إليه تيار الفجوات ( تيار الأقلية ) في حزمة
التكافؤ. |
المادة نوع
(
P )
|
P – Type Material
|
تسمى العناصر التي لها ثلاث
إلكترونات في غلافها الخارجي بالعناصر ثلاثية التكافؤ مثل (
البورون _ الألمونيوم ) عند إدخال هذه العناصر الشائبة في
بلورة جرمانيوم أو سليكون بواسطة التطعيم فإننا نحصل على مادة
نوع (p)
وتصبح ذرات الشوائب المضافة جزءاً مكملاً للتركيب البلوري
ولكنها تترك روابط تساهمية تفتقر إلى إلكترون واحد وهكذا تتشكل
الفجوات الإلكترونية في المادة نوع (p)
في المادة نوع (N)
تضيف الذرة الخماسية التكافؤ إلكتروناً حراً إلى التركيب
البلوري وتسمى ذرة مانحة (donor
atom)
في المادة نوع (p)
تترك الذرة الثلاثية التكافؤ التركيب البلوري مفتقراً إلى
إلكترون واحد . لهذا التأثير المعاكس تسمى الذرة الثلاثية
التكافؤ بالذرة القابلة (acceptor
atom)
والتي هي عكس الذرة المانحة.
عند تسليط قوة دافعة كهربائية
(emf)
عبر طرفي كتلة من مادة نوع (
p
) تتم إزاحة حاملات تيار الأغلبية والتي هي الفجوة الإلكترونية
باتجاه الطرف السالب لمصدر الجهد عند وصول الفجوة الإلكترونية
إلى النهاية المعدنية السالبة يدخل إلكترون من الدائرة
الخارجية لملئها . يحقن إلكترون بشكل تلقائي إلى النهاية
المعدنية الموجبة وتتكون فجوة إلكترونية جديدة تبعاً لذلك فإن
الإلكترونات في هذه الدائرة هي حاملات التيار في أسلاك التوصيل
والنهاية المعدنية ولكن الفجوات الإلكترونية تكون حاملات تيار
الأغلبية في داخل شبة الموصل. |